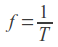W standardowej procedurze MS próbkę nakłada się na platformę i poddaje odparowaniu. Następnie jej składniki ulegają jonizacji, np. poprzez działanie strumieniem elektronów, a powstałe naładowane cząstki rozdzielane są w polu elektromagnetycznym na podstawie stosunku ich masy do ładunku. Aparaty do analizy MS składają się zwykle z trzech modułów: jonizatora, analizatora mas (w którym następuje sortowanie jonów) oraz detektora.
Chromatografia cieczowa natomiast wykorzystuje najczęściej złoża zbudowane z bardzo małych cząsteczek, a rozdział odbywa się pod wysokim ciśnieniem – jest to wysokosprawna chromatografia cieczowa (HPLC – ang. high performance liquid performance). W HPLC próbka nanoszona jest razem z fazą ruchomą, czyli płynem poddanym wysokiemu ciśnieniu, na kolumnę zawierającą fazę stacjonarną. W zależności od rodzaju materiału stosuje się odpowiednie złoża, na których zatrzymuje się izolowany preparat (np. poprzez oddziaływania hydrofobowe lub specyficzne), który następnie jest odzyskiwany dzięki użyciu odpowiedniego eluentu. Na etapie opuszczania kolumny przez ruchomą fazę ciekłą następuje jej rozpylanie, w celu uzyskania mikrokropelek. Podczas usuwania rozpuszczalnika uwalniane są molekuły analizowanej substancji, które rozdzielane są w procesie MS.
Ponieważ metoda MS umożliwia rozdział mikstury zawierającej wiele cząsteczek na podstawie ich mas, nasuwa się pytanie – czy potrzebny jest ich wstępny rozdział chromatograficzny? Odpowiedź brzmi tak, z dwóch bardzo ważnych powodów. Po pierwsze, wiele cząstek biologicznych posiada swoje izomery, czyli związki o identycznej masie. Spektrometria mas nie jest w stanie ich od siebie odróżnić, natomiast zastosowanie odpowiednich złóż chromatograficznych – owszem. Ponadto istnieje ryzyko supresji, kiedy podczas jonizacji cząstki mogą ulegać interakcji i wzajemnie wpływać na wydajność wytwarzania naładowanych cząstek. Jest to dużą przeszkodą zwłaszcza w sytuacji, gdy celem jest oddzielenie niewielkiej ilości cząsteczek od stanowiących przewagę cząstek innego rodzaju.
Połączenie chromatografii cieczowej ze spektrometrią mas daje więc korzyści wynikające z zastosowania obu tych metod naraz – analiza MS pozwala na wstępną identyfikację oczyszczonego produktu i ocenę jego czystości.
LC-MS charakteryzuje się wysoką czułością i selektywnością, ma także wiele zastosowań: oddzielanie materiałów, generalna detekcja i identyfikacja preparatu, np. składników wyekstrahowanych z produktów naturalnych czy też czystych substancji z mieszanin chemicznych półproduktów. Preparatywne systemy LC-MS mogą być stosowane w badaniach podstawowych, ale także w przemyśle farmaceutycznym czy spożywczym.
Magdalena Sokulska