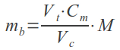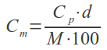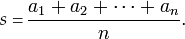Głównym założeniem real time PCR jest możliwość monitorowania ilości produktu w trakcie trwania doświadczenia. Taka kontrola „namnażania” badanego genu jest wynikiem zastosowania technik wykorzystujących zjawisko fluorescencji. Szczegółowy przebieg reakcji PCR w czasie rzeczywistym przedstawiono tutaj.
Do ilościowej analizy wyjściowego stężenia badanej matrycy wykorzystuje się obecnie dwie metody: absolutną i relatywną.
Metoda absolutna
Umożliwia określenie dokładnej ilości wyjściowej matrycy, wyrażonej w stężeniu lub liczbie kopii. Ustalenie początkowej ekspresji badanego genu jest możliwe dzięki zastosowaniu tzw. zewnętrznych standardów. Reakcje PCR prowadzone dla standardu oraz dla próbki badanej odbywają się w osobnych studzienkach na płytce. Wśród stosowanych standardów można natomiast wymienić rekombinowane plazmidy, genomowy DNA, produkty PCR lub syntetyczne oligonukleotydy.
– Dobry standard powinien cechować się przede wszystkim oznaczonym dokładnym stężeniem i liczbą kopii, a tym samym umożliwiać jak najdokładniejsze ilościowe oznaczenie badanej próbki - mówi dr n med. Małgorzata Małodobra-Mazur, diagnosta laboratoryjny, adiunkt Zakładu Technik Molekularnych Uniwersytetu Medycznego we Wrocławiu. - Dobór standardu powinien być podyktowany także rodzajem oznaczanego fragmentu DNA, a przynajmniej powinien być najbardziej zbliżony. Jeśli badamy ilość kopii DNA bakteryjnego czy wirusowego, idealnym rozwiązaniem jest posiadanie genomowego DNA. Innym rozwiązaniem może być plazmid zawierający analizowany gen bakteryjny lub wirusowy. Znaczenie przy wyborze ma także dostępność standardów.
Ponieważ metoda absolutna nie pozwala na wykrycie ewentualnych inhibitorów reakcji PCR, wykorzystuje się dodatkowo tzw. kontrolę wewnętrzną. Stanowi ją matryca powielana przy użyciu tych samych starterów co sekwencja docelowa i charakteryzująca się tą samą efektywnością powielania. Kontrolę wewnętrzną dodaje się do próby badanej w określonym stężeniu (przy znanej wartości CT - cyklu progowego). Inna długość produktu powstałego na matrycy kontroli wewnętrznej oraz odmienny od próby badanej sygnał fluorescencyjny pozwalają na rzetelne wykluczenie lub potwierdzenie ewentualnych inhibitorów PCR.
Metoda relatywna
Metoda ta zwana jest inaczej metodą względną lub porównawczą. Ten model analizy opiera się na wyznaczeniu względnej różnicy poziomów ekspresji między próbą badaną, a próbą referencyjną. Na wstępie wyznacza się cykl progowy CT w obu próbach, a następnie porównuje się między nimi jego wartość w kolejnych cyklach reakcji PCR. Istotnym czynnikiem determinującym użycie danego genu referencyjnego jest podobna efektywność jego namnażania w porównaniu do badanego genu. Gen taki powinien również mieć stały poziom ekspresji w różnych tkankach, ale również przy różnych procedurach eksperymentalnych. Do najczęściej stosowanych należą m.in. gen β-aktyny, dehydrogenazy aldehydu 3-fosfoglicerynowego (GAPDH) i β-glukuronidazy (β-GUS).
Teoria teorią...
Jak zatem ocenić, która z metod analizy real time PCR jest adekwatna do naszych doświadczeń? Dobór metody analizy ilościowej zależy przede wszystkim od rodzaju eksperymentu oraz oczekiwanych wyników. Ponadto uzależniony jest także od dostępności standardu niezbędnego do sporządzenia krzywej standardowej zauważa Małgorzata Małodobra-Mazur. Metodę absolutną stosujemy zawsze wtedy, gdy mamy dostęp do standardu, dla przykładu przy ilościowym oznaczaniu kopii wirusów lub bakterii. Na rynku obecne są komercyjne DNA różnego rodzaju wirusów czy bakterii o znanym stężeniu. Metodę absolutną powinniśmy stosować zawsze w przypadku możliwości sporządzenia krzywej standardowej, ponieważ w ten sposób jesteśmy w stanie dokładnie określić ilościowo dany fragment DNA w badanej próbce, bazując na wynikach krzywej standardowej. Z kolei metodę relatywną stosujemy wszędzie tam, gdzie nie mamy możliwości pozyskania standardu, dla przykładu DNA komórki nowotworowej, komórek wątrobowych itd.
Poziom ekspresji badanych genów określa się wówczas na podstawie różnicy pomiędzy poziomem ekspresji badanego genu, a poziomem ekspresji genu metabolizmu podstawowego. Dobrą praktyką laboratoryjną jest stosowanie co najmniej dwóch genów metabolizmu podstawowego. Przy tego typu analizie niezmiennie ważne jest, aby gen metabolizmu podstawowego cechował się stałą, niezmienną ekspresją w komórkach eksperymentalnych w porównaniu do kontrolnych, np. był taki sam w zdrowych komórkach oraz komórkach nowotworowych. Istnieje wiele metod analizy wyników. Jedną z najpopularniejszych jest metoda delta-delta Ct, czyli różnica różnic wartości Ct.
Anna Palko - Łabuz
Źródla:
http://www.pfb.info.pl/files/kwartalnik/4_2008/06.%20ciesielska-sikorski.pdf
www.gene-quantification.de/platform.html
www.pfb.info.pl/files/kwartalnik/1 2008/tyburski-studzinska.pdf