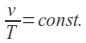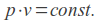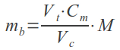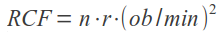Zgodnie z punktem 2 preambuły rozporządzenie nie znajduje zastosowania dla homeopatycznych produktów leczniczych bez wskazań oraz tradycyjnych produktów leczniczych roślinnych zarejestrowanych na podstawie odpowiednio art. 20a i art. 21a ustawy Prawo farmaceutyczne, które podlegają uproszczonej procedurze rejestracyjnej. Tym samym po 4 sierpnia 2013 r. tylko do tych produktów będzie stosowane w całości rozporządzenie Ministra Zdrowia z dnia 30 kwietnia 2012 r. w sprawie dokonywania zmian w pozwoleniu i dokumentacji dotyczącej wprowadzania do obrotu produktu leczniczego.
Rozporządzenie Komisji (WE) nr 1234/2008 nie określa wzoru formularza wniosku o dokonanie zmiany właściwego dla zmian dotyczących produktów leczniczych posiadających pozwolenia narodowe tj. objętych rozporządzeniem nr 712/2012. Jednocześnie z uwagi na fakt iż żaden przepis prawa wspólnotowego nie określa wzoru wniosku dla ww. produktów leczniczych, natomiast wzór APPLICATION FOR VARIATION TO A MARKETING AUTHORISATION jest dostępny wyłącznie w języku angielskim i stanowi jedynie wytyczną mającą charakter fakultatywny, wniosek o dokonanie zmiany w pozwoleniu i dokumentacji dotyczącej wprowadzenia do obrotu produktu leczniczego odnoszący się do produktów leczniczych zarejestrowanych w procedurze narodowej w języku polskim zostanie opublikowany na stronie internetowej URPL. Do czasu publikacji stosowany będzie wniosek w języku angielskim: http://ec.europa.eu/health/files/eudralex/vol-/c/variatio_form__201307_en.docn
Więcej informacji na stronie: http://www.urpl.gov.pl
Materiał przygotowała: Marzena Szwed, redaktor naukowy portalu biotechnologia.pl