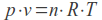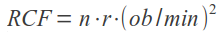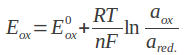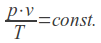Wniosek o przegląd danych dla bromokryptyny został złożony przez francuską agencję leków (ANSM), w związku z rzadkimi, ale potencjalnie ciężkimi lub śmiertelnymi działaniami niepożądanymi, w szczególności dotyczącymi układu krążenia (np. zawał serca lub udar), układu nerwowego (np. napady drgawkowe) i z powodu psychiatrycznych działań niepożądanych (np. halucynacje lub epizody maniakalne). ANSM uznało, że wystąpienia takich zagrożeń nie jest do zaakceptowania biorąc pod uwagę fakt, że proces laktacji jest naturalny i kończy się, kiedy dziecko nie jest karmione piersią, a dostępne są inne dopuszczone produkty, jeśli istnieje potrzeba jego hamowania. Komitet ds. Oceny Ryzyka w Ramach Nadzoru nad Bezpieczeństwem Farmakoterapii Europejskiej Agencji Leków (PRAC) przeanalizuje dostępne dane dotyczące stosunku korzyści do ryzyka stosowania leków doustnych zawierających bromokryptynę w zapobieganiu lub hamowaniu laktacji oraz wyda opinię w sprawie dopuszczania do obrotu tych leków w państwach członkowskich Unii Europejskiej (UE).
Więcej informacji znajduje się w załączonej poniżej informacji Europejskiej Agencji Leków (EMA) oraz jej tłumaczeniu.
Redaktor: Marzena Szwed