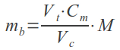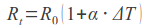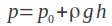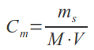Na czym opiera się mechanizm FRET? Otóż jeden z chromoforów (zwany donorem) może przekazywać energię wzbudzenia drugiemu (akceptorowi), jeśli ten znajduje się w odległości nie większej niż 10 nm. Kolejnym warunkiem jest różnica w widmach absorpcji i emisji promieniowania fluorescencyjnego (jeśli stosujemy znakowanie tego typu) dla obu chromoforów. W przypadku, gdy wszystkie te warunki są spełnione, wzbudzając donor wiązką o długości fali odpowiadającej maksimum jego absorpcji, zaobserwujemy emisję promieniowania o długości fali odpowiadającej maksimum emisji akceptora. W przypadku większej odległości pomiędzy białkami, oznaczającej brak oddziaływań, nie dochodzi do transferu energii i obserwujemy jedynie emisję donora, o długości fali odpowiadającej jego maksimum.
Do znakowania białek stosuje się różnego rodzaju markery, jak np. białko zielonej fluorescencji (GFP) i jego modyfikacje. Takie znaczniki są o tyle korzystne, że można je łatwo dołączyć do badanych protein poprzez wykorzystanie technik biologii molekularnej. Istnieje wiele wariantów GFP o różnych kolorach, a co za tym idzie – o różnych maksimach absorpcji i emisji, a takie właśnie różnice wymagane są w celu zastosowania markerów w mechanizmie FRET. Oczywiście oprócz badania interakcji międzybiałkowych, technika ta ma wiele innych zastosowań.

Jakie są natomiast wymagania odnośnie sprzętu? Wystarczy zwykły mikroskop fluorescencyjny, którego parametry zależą od rodzaju próby, w której znajdują się badane cząsteczki, trybu obrazowania i rodzaju użytych fluoroforów. Podczas przeprowadzania obserwacji należy pamiętać o kilku ważnych aspektach:
- należy ściśle kontrolować stężenia fluoroforów donorowych i akceptorowych. Zazwyczaj najwyższe prawdopodobieństwo zaobserwowania FRET osiąga się wtedy, gdy kilka cząsteczek akceptora przypada na pojedynczą cząsteczkę donora;
- spektra emisji donora i absorpcji akceptora powinny w znacznym stopniu się pokrywać;
- spektra absorpcji i emisji donora powinny pokrywać się w jak najmniejszym stopniu, aby zminimalizować niebezpieczeństwo transferu z donora na donor;
- długość życia fluorescencji donora powinna być na tyle długa, aby zdążył zajść transfer energii;
- długości fali odpowiadające emisji zarówno akceptora, jak i donora, powinny być dopasowane do maksymalnego zakresu czułości detektora;
- żywe komórki znakowane markerami będącymi modyfikacjami GFP powinny być analizowane przy użyciu standardowych metod immunohistochemicznych. Dzięki temu można sprawdzić, czy otagowane białko w komórce posiada te same właściwości co jego natywny odpowiednik bez markera.
Magdalena Sokulska